Odborné stanovisko k pořadu "Máte slovo" na téma "Jídlo škodící zdraví"
- Podrobnosti
- Kategorie: Doporučení a stanoviska České společnosti pro výživu a vegetariánství

1. Úvod
Správně poskládaná a vyvážená strava, jako prostředek k docílení pevnějšího zdraví a dlouhého života, je v naší moderní společnosti velice často diskutovaným tématem. Otázka zdravého stravování byla dne 12.1. 2017 otevřena v pořadu Máte slovo České televize.
Po zhlédnutí tohoto dílu byli mnozí diváci spíše zmateni, než poučeni a bohužel se není čemu divit. Vedená diskuze nebyla ucelená a mnohdy výrazně odbočovala od vytyčených témat. Z toho důvodu tedy nenesla pro diváka žádoucí informační hodnotu.
Mezi diskutovaná témata patřila např. konzumace masa (výhody a nevýhody), obsah nejrůznějších živin (především vápník, železo a zinek) v zelenině a ovoci s uvedením místy nesprávného zástupce potraviny jakožto zdroje dané živiny, a v neposlední řadě zkušenosti paní chronické dietářky s pochybnými ,,výživově-relaxačními“ aktivitami, které nemají nic společného s žádným uceleným výživovým směrem. Dále je nutné podotknout, že celé diskuzi chyběla určitá kultivovanost a mnohdy odbočovala od relevantních a podložených faktů např. z odborných impaktovaných publikací.
Vzhledem k některým výrokům, které padly během pořadu, byl vypracován rozbor za účelem osvětlit laické veřejnosti některá nesprávně interpretovaná fakta.
2. Rozbor argumentů
Důležitá témata celé diskuze:
2.1 Nepochopení výživových směru
2.2 Bílkoviny
2.3 Vápník
2.4 Železo a ostatní nutrienty
2.1 Nepochopení výživových směrů
Prof. Ing. Jana Dostálová, CSc.: ,,Když budeme jenom na zelenině a ovoci, tak nám bude chybět řada dalších živin… protože zelenina a ovoce prakticky neobsahují bílkoviny (proteiny), které jsou nutné k tvorbě svalové hmoty. ...bude chybět materiál pro tvorbu svalové hmoty..." Ovoce a zelenina až na některé výjimky neobsahují tuky. Běžné druhy ovoce a zeleniny tuky neobsahují, takže máte deficit řady živin…”
Jak již víme, diskuze v tomto díle pořadu „Máte slovo“ byla na téma zdravé / nezdravé stravování a alternativní výživové směry, především vegetariánství. Zástupci odborné veřejnosti byl prezentován a následně oponován fiktivní, v praxi neexistující výživový směr. Proto základní problém vidím v absenci definování diskutovaných způsobu stravování. Dále uvádím stručnou nutriční definici na vegetariánství zaměřených výživových směrů:
- laktoovovegetariáni – vynechávají pouze maso, nicméně vajíčka společně s mlékem a mléčnými výrobky zařazují do svého jídelníčku;
- laktovegetariáni – ti oproti laktoovovegetariánům, vynechávají maso a vejce;
- vegetariáni vyloučující veškeré potraviny živočišného původu, tedy veganství.
Samozřejmě existuje i celá řada dalších výživových směrů s jinou filosofickou nadstavbou, které rovněž upřednostňují potraviny rostlinného původu, jako jsou frutariánství, raw-veganství neboli vitariánství apod. Data získaná na těchto dvou méně početných skupinách zatím nepodávají úplný obraz o vztahu mezi stravováním a zdravím, a to z důvodu jejich krátkého historického vývoje.
Před rozborem výroků obou odborníků bych chtěl zdůraznit, že žádný z výše uvedených nejpočetnějších vegetariánských výživových směrů, se neomezuje pouze na konzumaci ovoce a zeleniny, nýbrž zahrnuje i konzumaci ořechů, semínek, luštěnin, obilnin, za studena lisovaných olejů apod.
V dnešní době z dostupných odborných studií dobře víme, že existují rostlinné potraviny s vysokým obsahem bílkovin, např. luštěniny, sojové boby a sojové produkty, quinoa, amarant, semínka a ořechy, dále také zdroje kvalitních tuků diskutovaných níže (viz. kapitola 2.3 Železo a ostatní nutrienty). 1,2
2.2 Bílkoviny
MUDr. Petr Tláskal, CSc.: V pořadu zmiňuje důležitost masa z hlediska obsahu esenciálních aminokyselin.
Prof. Ing. Jana Dostálová, CSc.: „...Pak co se týče minerálních látek, ta využitelnost je velice špatná. Třeba jak jsem mluvila o železe, ale i vápník....“
Samotné bílkoviny jsou především ceněné pro svůj obsah esenciálních aminokyselin, které si lidský organismus nedokáže vyrobit. V moderní společnosti však panuje řada mýtů a dezinformací. Především názor, že proteiny rostlinného původu nejsou tzv. plnohodnotné z pohledu spektra aminokyselin, zvláště těch esenciálních. Dále je také velmi často diskutovaná jejich nízká stravitelnost.
Z výzkumů vyplývá hned několik faktů. Dle současných poznatků se ukazuje, že kombinace rostlinných potravin bohatých na bílkoviny, dle bílkovinné komplementarity, zaručuje dostatek aminokyselin, v celém jejich spektru.3 V nedávné době bylo prokázáno, že kombinování potravin bohatých na rostlinné bílkoviny již není nutné v rámci jednoho pokrmu. Tělo si totiž dokáže udržovat rezervoár určitých aminokyselin, pro doplnění aminokyselinového spektra bílkovin získaných z potravy v průběhu dne.4,5 Otázce vstřebatelnosti, resp. stravitelnosti bílkovin rostlinného původu byla věnována pozornost i v reportu Světové zdravotnické organizace. Zde bylo poukázáno na fakt, že rozdíly mezi jednotlivými druhy bílkovin jsou zanedbatelné.6
Co vidím jako chybějící článek v mnoha diskuzích na téma tzv. plnohodnotnosti bílkovin popř. potravin bohatých na bílkoviny je především porovnání potravin bílkovin živočišného a rostlinného původu z hlediska množství ,,ochranných látek“ či fytochemikálií, které jsou především známé jako sekundární metabolity rostlin.
Příkladem ,,ochranné látky“ může být vláknina, která je velmi hojně zastoupená v rámci vegetariánské a veganské stravy. V porovnání s konvenčním způsobem stravování, se u vegetariánského popř. veganského způsobu stravování jedná o nárůst množství vlákniny o 50 – 100%.7
V případě pouhého zařazení potravin bohatých na rozpustnou vlákninu, rostlinné steroly nebo např. sojové isoflavony, dochází ke snížení absorpce nebo k obecnému snížení celkového cholesterolu v krvi, dále pak ke snížení hladiny LDL cholesterolu a potažmo k zabránění jeho oxidaci. Důsledkem je snížené riziko vzniku koronárních onemocnění srdce a kardiovaskulárních onemocnění jako takových.8-10
Meta-analýza 10 randomizovaných klinických zkoušek zabývajících se vlivem sojových flavonů na ztrátu kostní hustoty u žen po menopauze, prokázala významný pozitivní vliv na hustotu minerálů v kosti (BMD) páteře, což je velmi důležitým faktorem pro prevenci vzniku osteoporózy.11
Fytochemikálie vykazují i celou řadu dalších účinků, např. snížení srážlivosti krevních destiček, zlepšení vazodilatace cév, antioxidační a protizánětlivé účinky.12-14
V závěrečné části této sekce byla věnována pozornost celé řadě ochranných látek a jejich vlivu na zdraví a prevenci civilizačních onemocnění. V první řadě bychom neměli hodnotit ne/plnohodnost dané potraviny pouze z pohledu množství aminokyselin či jejich stravitelnosti, ale jako komplexní soubor živin a jejich dopad na naše zdraví.
2.3 Vápník a zdraví kostí
1.) Prof. Ing. Jana Dostálová, CSc.: ,,Pokud vápník nepříjímáte z mléka a mléčných výrobků, tak velice obtížně naplníte ty doporučené dávky, ale hlavně pro děti nezajistíte dobrý růst. Proč si ceníme mléka a mléčných výrobků… Obsahují velké množství vápníku, navíc s dobrou využitelností, když to srovnáme z rostlinných zdrojů, tak třeba z toho špenátu nebo z některých zelenin je to jen 1% a kdežto z mléka je to přes 30%. Takže mléko je bohatý zdroj vápníku a navíc s dobrou využitelností. “
Konzumace vápníku (Ca) a vliv na zdraví kostí je jedním z nejčastěji diskutovaných témat současné doby. Výživová doporučení příjmu Ca se mnohdy velice liší a v současné době nejsou tato doporučení jednotná. Co zůstává podstatnou otázkou v této oblasti je využitelnost Ca. Vztahem mezi příjmem Ca a jeho absorpcí popř. vyloučením se zabývaly WHO reporty z roku 2002 a 2004, kde byl diskutován vztah mezi absorpcí/exkrecí a příjmem Ca.
Požadavek na příjem Ca (mg) byl vypočítán dle grafického vztahu, kdy se absorbovaný Ca rovnal vyloučenému. Na grafu 1 můžeme vidět dvě křivky tzv. ,,True“ a ,,Net“. Křivka s označením „True“ vyjadřuje celkový Ca vstřebávaný střevním aparátem. Křivka „Net“ ukazuje rozdíl mezi absorbovaným Ca a fekálním vápníkem (ztráty Ca stolicí). Zprvu při nulovém příjmu vápníku reprezentuje fekální Ca endogenní (vnitřní) množství Ca, které se nereabsorbuje. Se zvyšujícím se příjmem Ca stoupá ,,Net“ křivka tzn. křivka absorpce Ca až po hodnotu 520 mg, kdy je systém aktivního transportu Ca plně saturován. Poté již tato křivka pozvolna klesá a tedy i absorpce Ca.

Graf 1 – Závislost absorpce Ca na jeho příjmu (převzato z Report of a Joint FAO/WHO Expert Consultation, Bangkok,
Thailand: World Health Organization; 2002.)
Hodnota příjmu 520 mg Ca však nepočítá se ztráty vápníku jinými cestami nežli močí.15, 16 Z tohoto důvodu se v případě západního způsobu stravování zvýšila hodnota příjmu na 840 mg u dospělých jedinců a dále na 1100 mg u žen po menopauze viz (graf.2).17, 18

Graf 2 – Vztah mezi příjmem Ca a jeho absorpcí (převzato z Report of a Joint FAO/WHO Expert Consultation, Bangkok, Thailand: World Health Organization; 2002)
Na využitelnost vápníku má vliv nejen jeho celkový příjem, negativně ho však ovlivňuje i zvýšený příjem proteinů a sodíku.19 Obecně mají konvenčně se stravující jedinci o 19 g vyšší příjem bílkovin oproti vegetariánům a o 30 g v porovnání s vegany. Příjem sodíku mají vegetariáni 1,5 krát nižší, než konvenčně se stravující jedinci. U veganů je daný příjem 2,5 krát nižší.19
Od roku 1961 je znám vztah mezi vyloučeným Ca a Na. Bylo zjištěno, že příjem sodíku zvyšuje hladiny vyloučeného vápníku, z důvodu kompetice Ca a Na během reabsorpce v ledvinách.20 Ze vzájemného vztahu Ca a Na víme, že 100 mmol (2,3 g) Na indukuje vyloučení 1 mmol Ca (40 mg).21, 22 Kdybychom snížili příjem Na ze 3,45 g na 1,15 g, můžeme teoreticky snížit doporučenou dávku Ca z 840 mg na 600 mg. Daná spojitost je demonstrována v grafu 3.
V řadě studií byla podobná souvislost nalezena i mezi příjmem živočišných bílkovin a množstvím vyloučeného vápníku.23-25 Ve vztahu ke grafu 3 proveďme úvahu. Pokud bychom snížili množství živočišných bílkovin o 40 g (podobně jako je tomu v rozvojových zemích), potom lze očekávat stejné snížení doporučeného příjmu Ca jako v případě příjmu Na.
Kdybychom vzali v úvahu snížení množství Na a bílkovin o zmíněné hodnoty, můžeme tedy počítat s celkovým snížením potřeby příjmu Ca až na hodnotu 450 mg.18

Graf 3 – Křivka znázorňující absorpci Ca v závislosti na jeho přijatém množství a její následné ovlivnění příjmem sodíku a bílkovin (převzato z Joint FAOWHOECoHV, Mineral R. Vitamin and mineral requirements in human nutrition. Geneva: World Health Organization; 2004)
Nyní proveďme úvahu nad vhodností doporučených dávek Ca, vzhledem ke konvenčně se stravující populaci, pro kterou činí 840 mg/den. Jak již bylo zmíněno, vegetariáni a vegani konzumují 1,5 krát, resp. 2,5 krát nižší množství Na, dále také o 19, resp. 30 g méně bílkovin. Z výše uvedeného vyplývá, že obecná doporučení příjmu Ca 840 mg/den nemusí být plně adekvátní.
Dalším faktorem jako je adekvátní příjem hořčíku (Mg), podílející se na příjmu, absorpci a biologické funkci Ca, který nebyl zmíněn v rámci diskuze pořadu, je zahrnut v následujících odstavcích o vápníkovém paradoxu. Dále věnuji pozornost možným rizikům vztahující se k poměru Ca:Mg ve stravě.
V otázce využitelnosti vápníku ze zeleniny byl v pořadu zmíněn špenát, u kterého víme, že je to zelenina s vysokým obsahem oxalátů, což samozřejmě výrazně snižuje využitelnost vápníku v jeho nativní formě. Špenát také patří do skupiny zeleniny s téměř nejhorší využitelností vápníku. Naproti tomu máme celou řadu druhů zeleniny a potravin s vysokou biologickou využitelností vápníku, jmenovitě brokolice, bok choy, kapusta a ovocné džusy obohacené o jablečnan vápenatý. Jejich biologická využitelnost vápníku se pohybuje v rozmezí 40-60%.
Zmíněná biologická využitelnost kravského mléka se přitom pohybuje na podobných hodnotách jako tofu s vápníkem (30-35%).26, 27 Hodnoty Ca v mg jsou uvedeny v tabulce 1.
|
Potravina |
Ca [mg]/ 100g |
|
brokolice |
47 |
|
kadeřávek |
150 |
|
kapusta |
232 |
|
pomerančový džus |
70 |
|
Tofu (nigari) |
683 |
|
mák (semínka) |
1438 |
Tab. 1 – Množství Ca ve vybraných potravinách.
(Data převzata z USDA National Nutrient Database for Standard Reference Release 28, https://ndb.nal.usda.gov/ndb/search/list)
Pro shrnutí lze tedy říci, že nelze s jistotou aplikovat obecná doporučená množství Ca 840 mg pro alternativně se stravující skupiny jako jsou vegetariáni a vegani. Pravdou ale zůstává, že by se lidé stravující těmito směry měli řídit všeobecným doporučením minimálního příjmu 400-500 mg Ca, kvůli prevenci vzniku osteoporózy.28 Dále můžeme říci, že existují potraviny rostlinného původu s vysokou využitelností Ca, potom také potraviny se střední, případně nižší vstřebatelností Ca. Nicméně, některé kulinářské techniky nabízí řešení tohoto problému. Například pouhým vařením potravin s vyšším obsahem antinutrientů (např.: oxaláty) ve vodě nebo v páře můžeme redukovat tyto anti-nutrienty, které jsou zodpovědny za onu horší vstřebatelnost Ca.29
2.) pan Škvařil: Zmiňuje Vápníkový paradox a odkaz na studii WHO 2003 – souvislost mezi konzumací
mléčných výrobků a výskytem osteoporózy ve sledovaných státech.
,,Čím více konzumujeme vápník v podobě mléka, tím je vyšší výskyt osteoporózy v těchto státech.”
paní Dostálová: ,,To není pravda.”
Vápníkový paradox, neboli skutečnost, že dochází k vyššímu výskytu zlomenin kyčle ve vyspělých zemích i přes vyšší příjem vápníku, je znám již delší dobu.18, 28, 30 Původní práce doktora Hegsteda poukazuje na zvýšenou četnost fraktur kyčle v zemích, kde je vysoký příjem a majoritní podíl vápníku přijímán v podobě mléka a mléčných výrobků. Naopak u států s nízkým příjmem vápníku ve formě mléka a mléčných výrobků dochází k velice nízké incidenci fraktur. Dále uvádí spojitost mezi příjmem bílkovin z živočišných zdrojů a výskytem fraktur kyčle (viz graf. 4). Dle WHO reportu no. 91, není příčina tohoto jevu jasně známa, nicméně poukazuje na vztah metabolismu bílkovin živočišného původu a jeho vliv na zdraví kostí.18
Výsledky epidemiologických a kros-kulturních studií naznačují souvislost mezi příjmem bílkovin jako takých, popř. bílkovin živočišného původu.18, 30, 31 V případě kros-kulturní studie Abelow a kol., uvádí souvislost mezi příjmem živočišné bílkoviny a výskytem fraktury kyčle (viz graf 5) napříč rozvojovými zeměmi v Asii a Africe, kde je podíl potravin bohatých na živočišné bílkoviny minoritní, až po země rozvinuté jako je např. Švédsko, Nový Zéland, USA apod, kde je situace naprosto opačná.30
Velice zajímavé bylo i pozorování většího počtu fraktur u afroamerické populace žen v USA ve srovnání s velice nízkým výskytem zlomenin u afrických žen jižní Afriky.31

Graf 4 – Souvislost výskytu fraktur kyčle s množstvím konzumovaného vápníku u žen v jednotlivých státech (převzato z Hegsted DM. Calcium and osteoporosis. J Nutr. Nov 1986;116(11):2316-2319).
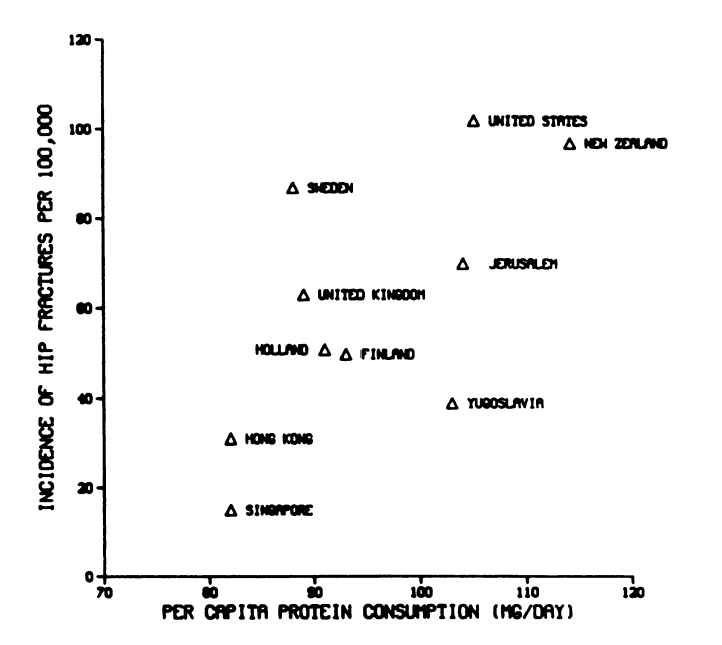
Graf 5 – Souvislost výskytu fraktur kyčle a množstvím konzumovaných bílkovin u žen v jednotlivých státech (převzato z Hegsted DM. Calcium and osteoporosis. J Nutr. Nov 1986;116(11):2316-2319).

Graf 6 – Souvislost výskytu fraktur kyčle a množstvím konzumovaných bílkovin živočišného původu u žen po
50. roku věku v jednotlivých státech (převzato z Abelow BJ, Holford TR. Insogna KL. Cross-cultural association between dietary
animal protein and hip fracture: a hypothesis. Calcif. Tissue Int. Jan 1992;50(1):14-18.)
Příčina daného jevu tkví pravděpodobně ve více faktorech. Jako jeden z vlivů byla zjištěna korelace mezi vysokým příjmem celkových bílkovin (živočišného i rostlinného původu) spolu s nízkou hladinou vitamínu D.32-40
Ve studii trvající 12 let bylo sledováno celkem 121 tis. žen v 11 státech, u nichž byl zjišťován vliv konzumace mléka popř. příjmu vápníku na vznik rizika zlomenin kostí. Nebyl však nalezen žádný důkaz o snížení rizika zlomenin kyčle a předloktí u žen s vyššími dávkami mléka. Autoři studie poukazují na fakt, že u žen konzumujících delší dobu vyšší dávky vápníku z mléčných výrobků, mírně roste riziko zlomenin kyčle v čase, závislost byla jasně prokázána se statistickou významností. Na druhou stranu u žen, které přijímaly vápník z jiných zdrojů, tato souvislost nebyla nalezena. Dále autoři naznačují, že by příčinou rizika zlomenin u skupiny konzumující mléčné výrobky, mohla být mléčná bílkovina.41
Jedno z pravděpodobných vysvětlení mechanismu vzniku vápníkového paradoxu tkví v tzv. potenciální renální zátěži kyselostí (PRAL), způsobené metabolismem bílkovin bohatých na sirné aminokyseliny. Takto vzniklá kyselost je poté ,,neutralizována“ vápníkem resorbovaným z kostí a jeho následné vyloučení močí tzv. kalciurie.42-47
Existence vápníkového paradoxu je i v naší době diskutovaným tématem světové zdravotnické organizace, která na tento fakt upozornila ve třech svých třech reportech.6, 18, 28
2.3.1 Nediskutované téma – role Hořčíku
Celá diskuze o osteoporóze a zlepšení denzity kostí byla úzce zaměřena na příjmy vápníku jako prvku, který hraje hlavní roli v prevenci vzniku této choroby. Existuje celá řada nutrientů, které mají přímý vliv na zdraví kostní tkáně. Jedním z těchto nutrientů je např. hořčík, který se až z 60% nachází v kostech. Je přítomný v kortikální (tvrdé) části kosti, nebo i v samotných strukturách apatitového krystalu.48
Funkce Mg byly studovány pomocí snižování nebo úplné deficience dávek Mg v rámci v in vivo studií. Zde bylo dokázáno, že Mg hraje významnou roli pro tvorbu kostní tkáně. Jeho deficit vedl výraznému ovlivnění vlastností struktury kostí a klíčových markerů produkce kostní tkáně.49 Další preklinické studie pozorovaly vliv nutriční restrikce popř. deficience Mg, kdy nízký příjem Mg způsobil zeslábnutí, zkřehnutí kostí, či patologické změny uvnitř kostí subjektů.48, 50
Velké množství publikací ukazuje na fakt, že Mg se podílí na celé řadě procesů spojených tvorbou a strukturou kostní a pojivové tkáně.51 Vůbec nejdůležitější je skutečnost, že Mg ovlivňuje i aktivitu kostních buněk podílejících se na výstavbě nových kostí – osteoblastů a buněk, které naopak rozrušují kostní tkáň - osteoklasty. Deficit Mg se v tomto případě projevil redukcí počtu osteoblastů 52, 53 a ovlivněním jejich funkčnosti.51 Naproti tomu byly pozorovány značně se zvyšující počty osteoklastů.54
Mnohé studie se snažily odhalit vztah mezi Mg a jeho vlivu na zdraví kostí i v rámci různých věkových skupin. Práce Abrams a kol. zabývající se příjmem Mg a vlivem na hustotu minerálů v kosti (BMD), nalezla malý, nicméně statisticky signifikantní vztah mezi příjmem Mg a zvýšením BMD u dětí (4-8 let), při dávkách 130 mg.55 Pozitivní vliv suplementace Mg na kostní hustotu, ale i obsah minerálů (BMC), byl pozorován i v rámci randomizované studie na dívkách (8-14 let). Zde došlo ke zvýšení BMC kyčelních kostí v porovnání s placebo skupinou.56 Podobný efekt Mg na BMD celého těla byl pozorován i u starších subjektů.57
Z biochemického hlediska je i samotná homeostáza Ca (udržování stálé hladiny Ca) závislá na hladinách Mg. V případě nízkého množství Mg hrozí, že dojde k negativnímu ovlivnění dvou regulátorů Ca homeostáze, a to parathyroidního hormonu (PTH) a 1,25-(OH)2-vitamínu D, který jak je známo, má souvislost s prevencí osteoporózy. Celkově vlivem této dysregulace dochází k hypocalcemii, čili ke snížení množství Ca v krevním séru.58
Z výše uvedených faktů tedy vyplývá, že Mg hraje zásadní roli pro zdraví kostní tkáně. A je tedy logické, že bychom na tento prvek neměli pohlížet jako na marginální mikronutrient, především ve vztahu k Ca homeostáze. Mimo výše zmíněné biologické funkce Mg včetně homeostáze Ca, je Mg i přírodním antagonistou Ca (regulátorem Ca indukovaných procesů).59 Rovnováha mezi Ca a Mg má vliv nejen na zdraví kostní tkáně, ale i na celou řadu dalších orgánových soustav. Proto i samotný poměr mezi Ca:Mg ve stravě hraje svou roli ve vztahu ke zdraví, jeho neustále se zvyšující trend však sebou může nést negativní účinky, viz následující kapitola.
2.3.2 Poměr mezi Ca a Mg
Mimo obecnou funkci Mg v rámci homeostázy Ca, popř. prevenci osteoporózy, nebyl v celé diskuzi zmíněn poměr Ca:Mg ve vztahu rovnováze Mg v těle (absorpce a vylučování Mg) případně trend stále se zvyšujícího poměru Ca:Mg a jeho nežádoucích účinků na organismus.
V této oblasti bylo zjištěno, že nízký příjem Mg (250 mg/den) společně se zvyšujícím se příjmem Ca (z 200mg/den na 1400mg) vedl k negativní rovnováze Mg (absorpce < vylučování). Naopak je tomu v případě příjmu 500mg/den, kde došlo k navrácení Mg rovnováhy (absorpce > vylučování).60, 61 V tomto případě jde o molární poměr Ca:Mg, 1,7:1.
Na toto zjištění navázala studie prováděná na mladých ženách v USA, u kterých byl příjem Mg kontrolován dle RDA systému, zatímco Ca nebo např. příjem fosfátu (PO43-) byl dán stravovacími návyky. V této studii byl zjištěn vysoký poměr Ca:Mg a PO43-/Mg, což se negativně odrazilo na Mg rovnováze.62
V další studii provedené Normanem a kol. byl pozorován vliv absorpce Mg (příjem 173-200 mg/den) ve dvou oblastech tenkého střeva (jejunum a ileum) u skupin zdravých dobrovolníků (22-35 let) s nižším (198 mg/den) a vyšším příjmem Ca (1878 mg/den). V této studii bylo zjištěno snížení absorpce Mg v jejulu (lačníku), ale především v ileu (kyčelníku) se statistickou významností u skupiny s vysokým příjmem Ca.63 V případě nižšího podílu Ca ve stravě se jedná o molární poměr 0,6:1 Ca:Mg. U vyššího podílu Ca byl poměr Ca:Mg roven 4:1.
Výše zmíněná fakta poukazují na vztah Ca a Mg popř. Ca:Mg poměru v rámci absorpce Mg organismem a zároveň poukazuje, že poměrně jednostranné zaměření pozornosti na zvyšování hodnot příjmu Ca ve stravě může mít i negativní vliv na často opomíjený mikronutrient jakým je Mg.
Mimo výše uvedená fakta existuje celá řada dalších studií o vlivu vysokého poměru Ca:Mg na zvýšený výskyt celé řady civilizačních onemocnění, jako jsou rakovina tlustého střeva, kardiovaskulární onemocnění (včetně hypertenze), inzulinová rezistence, obezita a diabetes. Dále také studie poukazují na procesy dějící se během těchto onemocnění na buněčné úrovni ve vztahu ke změnám koncentrací Ca či Mg uvnitř buněk.
Zajímavý se ukazuje trend zvyšujícího se Ca:Mg poměru v USA v období 1977-2008. Kdy v roce 1977 se tento poměr pohyboval v rozmezí 2,3-2,86 a naproti tomu v letech 2007-2008 vzrostl na 2,91-3,53.64 Konkrétně v v období 2001-2002, Dai a kol. našli souvislost mezi Ca:Mg poměrem >2,78 a zvyšujícím se rizikem rakoviny tlustého střeva. Na druhé straně se ukazuje, že snížení poměru Ca:Mg může hrát významnou roli v prevenci vzniku tohoto typu rakoviny. Například už pouhé snížení poměru Ca:Mg pod 2,78 vedlo k výraznému snížení rizika vzniku rakoviny tlustého střeva.65
Další zajímavou souvislost mezi poměrem Ca:Mg a počtem úmrtí na koronární onemocnění srdce (CHD) se zabývala studie Varo a kol. popř. Keys a kol. Jak je patrné z Grafu 4, se zvyšujícím se poměrem Ca:Mg dochází k nárůstu počtu úmrtí způsobené CHD především ve vyspělejších zemích.66, 67 Dle grafu 7, Finsko jako země s největším počtem úmrtí na CHD je také se zemí s nejvyšší konzumací mléka a mléčných výrobků u kterých je Ca:Mg poměr 12:1.66 Autoři studie odkazují na fakt, že průměrná finská dieta s vyšším obsahem Ca pravděpodobně způsobuje inhibici absorpce Mg ve střevech66 popř. jeho zvýšené vylučování.68

Graf 7 – Závislost zvyšujícího se poměru Ca:Mg na úmrtí způsobené CHD (převzato z VARO, P.: Mineral element balance and coronary heart disease Int.J. Vit. Nutr. Res. 44: 267-273 (1974). a Keys A. Coronary heart disease in seven countries. 1970. Nutrition. Mar 1997;13(3):250-252; discussion 249, 253.)
K velice zajímavým pozorováním došel Resnick a kol.69 při sledování dynamiky změn hladin Ca a Mg v červených krvinkách. Konkrétně byly sledovány změny Ca a Mg v prostředí uvnitř buňky (intracelulární prostor) v souvislosti s metabolickým syndromem, včetně hypertenzí, hyperinsulimie, inzulínové rezistence a hypertrofie levé komory. Porovnání hodnot normotenzivních a hypertenzivních pacientů byla zjištěna inverzní závislost mezi systolickým potažmo diastolickým tlakem a hodnotou intracelulárního hořčíku (Mgi) (graf 8). Dále bylo nalezeno, že všechny formy hypertenze jsou také charakteristické nejen velice nízkými hladinami Mgi, ale přebytky volného intracelulárního Ca (Cai).69
Podobně jako v případě korelace krevního tlaku a množstvím Mgi, byla zjištěna silná závislost mezi množstvím volného Cai a krevního tlaku.70 Mezi první studované tkáně s těmito abnormalitami patřily krevní destičky. Zde Erne a kol. objevili zvyšující trend volného Cai v krevních destičkách pacientů s hypertenzí (graf 9).71
V případě sledování změn Cai a Mgi byly ve studii Resnicka a kol posuzovány čtyři skupiny pacientů, normotenzivní (s normálním krevním tlakem) a hypertenzivní (s vysokým krevním tlakem) zdraví jedinci, a dále pak normotenzivní s hypertenzivní diabetičtí jedinci. Při porovnání hodnot krevního systolického tlaku (SBP), hodnot volného Mgi a Cai, byly nalezeny značné rozdíly v pozorovaných skupinách.
Například normotenzivní diabetici ve srovnání s normotenzivními zdravými jedinci trpěli vyšším SBP, dále měli vyšší hladiny volného Cai společně s nižšími hodnotami volného Mgi. Stejně tomu bylo i při srovnání hypertenzivních diabetiků se zdravými normotenzivními jedinci.
Na závěr byly porovnány skupiny dvou hypertenzivních (zdravých a diabetických pacientů) s normotenzivními zdravými jedinců. Kdy u obou hypertenzivních skupin, v porovnání se zdravými jedinci, byly nalezeny velké rozdíly v hodnotách Cai (vysoký hl.) a Mgi (nižší hl.).70

Graf 8 – Inverzní vztah mezi množstvím volného intracelulárního hořčíku a systolickým (SBP) popř. diastolickým krevním tlakem (DBP) u normotezivních a hypertenzivních jedinců
(převzato z Resnick LM. Ionic Basis of Hypertension, Insulin Resistance, Vascular Disease, and Related Disorders The Mechanism of “Syndrome X”. American Journal of Hypertension. 1993;6(4S):123S-134S).
Obecně se tedy ukazuje spojitost mezi zvýšeným množstvím Cai a nízkým množstvím Mgi a onemocněními jako jsou hypertenze, diabetes melitus II. typu nezávislý na inzulinu (NIDDM).70
Po zjištění vztahu zvýšeného Cai spolu se snížením Mgi a hypertenze se Resnick a kol. rozhodli pokračovat v hledání podobných abnormalit mezi Cai a Mgi u souboru onemocnění, nazývané metabolický syndrom. Konkrétně tedy studovali vztah mezi těmito mikronutrienty a insulinovou rezistencí, obezitou a NIDDM.
Při studiu vztahu Cai a Mgi a diabetu byla sledována odpověď pacientů na glukózový toleranční test (oGTT). V tomto případě byla nalezena silná inverzní souvislost mezi množstvím Mgi a hyperinsulemické odpovědi na oGTT. Čím nižší byla koncentrace Mgi, tím bylo zapotřebí více insulinu pro metabolismus standardní dávky glukózy (graf 10), což vysvětluje pozorování viz výše, ohledně inverzního vztahu Mgi a vysokého tlaku u diabetických jedinců.72
Podobně jako je tomu u hypertenze a množství Cai, byl nalezen stejný vztah i mezi zvyšujícím se množstvím Cai a hyperinsulemické odpovědi na oGTT. Čím vyšší byla hladina Cai, tím větší množství inzulínu bylo zapotřebí k metabolismu standardní dávky glukózy.73

Graf 9 – Vztah mezi množstvím Cai v krevních destičkách a krevním tlakem u jedinců s normálním a vysokým krevním tlakem (převzato z Erne P, Bolli P, Burgisser E, Buhler FR. Correlation of platelet calcium with blood pressure. Effect of antihypertensive therapy. N Engl J Med. Apr 26 1984;310(17):1084-1088.).

Graf 10 – Vztah mezi inzulinovou odpovědí a příjmem standardní dávky glukózy a úrovní ztráty Mgi (převzato z Resnick LM, Gupta RK, Gruenspan H, Alderman MH, Laragh JH. Hypertension and peripheral insulin resistance. Possible mediating role of intracellular free magnesium. Am J Hypertens. May 1990;3(5 Pt 1):373-379).
Dalším nezmiňovaným onemocněním, které má společný znak jako předchozí choroby, tedy snížený Mgi a zvýšený obsah Cai, či vysoký poměr Cai:Mgi, je zánětlivý syndrom. V rámci tohoto onemocnění se jedná o zvýšenou aktivitu buněčných signálních drah zprostředkovaných pomocí Ca. Velmi důležitou roli zde hraje i Mg deficience.74
V současné době se zdá, že regulace Ca a Mg je zprostředkována iontovými kanály TRPM. Ukazuje se, že z rodiny TRPM kanálů má největší podíl na regulaci Mg kanál TRPM7.75 Za fyziologického pH tento kanál váže Ca i Mg. Nicméně během dysregulace TRPM7 dochází k procesům, které způsobují vaskulární kalcifikaci včetně buněk hladkého svalstva. Vaskulární kalcifikace je jedním z patologických jevů, ke kterým dochází během aterosklerózy a proto i samotná regulace Mg a Ca těmito kanály může hrát významnou roli v rámci daného onemocnění. Co se ukazuje být zajímavé je fakt, že Mg má negativní vliv na vaskulární kalcifikaci, a to přes aktivitu TRPM7 kanálů a zprostředkování tvorby antikalcifikačních proteinů. Dá se tedy říci, že Mg/TRPM7 aktivita má v rámci procesů vaskulární kalcifikace protektivní roli.76
Závěrem mi dovolte shrnutí podstatných faktů z kapitoly 2.3. „Vápník a zdraví kostí“ z podkapitol zabývajících se funkcemi Mg, případně poměrem Ca:Mg.
Jak již víme, Ca a Mg hrají nepostradatelnou roli v rámci fungování nejen kostní tkáně, ale také během procesů buněčné signalizace, kde je nutná určitá rovnováha těchto mikronutrientů. Disbalance poměru Ca:Mg může mít tudíž velmi nebezpečné dopady na zdravé fungování organismu. Z předchozí kapitoly 2.3 „Vápník a zdraví kostí“ víme, že doporučení denního příjmu Ca v souvislosti s prevencí osteoporózy se neustále zvyšuje. Existuje několik faktorů, které ovlivňují vstřebatelnost Ca a tím i požadavek na denní příjem Ca. Jedním z faktorů je sodík ve formě soli (kuchyňské soli) a také příjem proteinů. Jak jsme si uvedli, v případě snížení příjmu sodíku z 3,45 g na 1,15 g, můžeme příjem Ca snížit z 840 mg na 600 mg. Dalším faktorem je příjem bílkovin. V tomto ohledu stačí už pouhé snížení o 40 g denního příjmu, čímž se dostáváme z hodnoty 600 mg denního příjmu Ca na 450 mg. Samozřejmě ve výše uvedeném příkladu se jedná o demonstraci vlivu dalších faktorů stravy na celkovou absorpci Ca.
Nicméně faktem zůstává, že existuje poměrně velká skupina lidí stravující tzv. alternativně (vegetariáni a vegani), která se vyznačuje výraznými rozdíly v příjmu např. těchto dvou nutrientů (sodík a bílkoviny).
V rámci příkladové studie Claryse a kol.19 bylo zjištěno, že vegetariáni a vegani příjmají oproti konvenčně se stravující skupině 1,5-krát a 2,5-krát méně sodíku. Dále je jejich příjem bílkovin o 19 g a 30 g nižší. Proto se domnívám, že doporučení denního příjmu Ca 840 mg, je pro tyto dvě skupiny zbytečně vysoké. Obecně je v rámci prevence osteoporózy doporučován příjem Ca v rozmezí 400-500 mg/den.28 Na to navazuje i studie provedená na jedincích stravující se veganskou stravou v porovnání s konvenčně se stravující skupinou. U veganů s denním příjmem Ca 525 mg, bylo nalezeno stejné riziko zlomeniny kyčle jako u konvečně se stravující skupiny.77 Fakt, že i při nižším příjmu Ca u těchto alternativně se stravujících skupin je riziko ke zlomeninám kyčle stejné jako u konvenčně se stravující populace, může poukazovat na vliv jiných nutrientů v rámci prevence osteoporózy u této skupiny.
Další část kapitoly „Vápník a zdraví kostí“ byla věnována fenoménu zvaném „Vápníkový paradox“ neboli skutečnost, že výskyt zlomenin kyčle jako ukazatele výskytu osteoporózy, je více přítomen v zemích s vyšším příjmem Ca. V zásadě se také jedná o země, kde je majoritním zdrojem Ca mléko a mléčné výrobky.18, 28, 30 Příčina tohoto jevu není zatím přímo určena,18 nicméně existují velice zajímavé souvislosti mezi množstvím příjmaných celkových bílkovin, či bílkovin živočišného původu a počtem fraktur pozorovaných v různých zemích. Nejvíce je to patrné ve studii Abelow a kol.31, kde země s majoritním podílem bílkovin živočišného původu mají zároveň vyšší podíl zlomenin kyčle (graf 6).
Možná příčina tohoto jevu tkví pravděpodobně v metabolismu sirných aminokyselin hojně zastoupených v mléku a mléčných výrobcích. Acidóza vzniklá produkty metabolismu těchto aminokyselin, případně fosfátovými zbytky, je kompenzována resorpcí Ca z kostí, což má za následek vyloučení poměrně velkého množství Ca močí.42-47 Mezi další faktory patří i nižší příjem, či deficit vitamínu D.32-40
Další část byla zaměřena na mikronutrient, který plní velice významnou roli ve vztahu k Ca homeostáze, zdraví kostí ale i v rámci fungování signálních drah v buňce. Tímto mikronutrientem je hořčík. V kapitole 2.3.1. „Nediskutované téma – role Hořčíku“ jsme se dozvěděli, že až 60 % veškerého hořčíku se nachází v kostní tkáni a že se významnou měrou podílí na samotné struktuře kostí a přímo ovlivňuje tvorbu kostí. Jeho deficit způsobuje celou řadu poruch kostní tkáně např. zkřehnutí kostí, patologické změny uvnitř struktur kostí. 48-50 Jedna z nejdůležitějších rolí Mg spočívá v regulaci aktivity buněk podílejících se na tvorbě (osteoblasty) a degradaci (osteoklasty) kostí, 51-54 dále ovlivňuje regulátory homeostáze Ca tj. parathyroidní hormon (PTH) a 1,25-(OH)2-vitamin D, který jak víme, hraje klíčovou roli v prevenci osteoporózy. V neposlední řadě také deficit Mg může negativně ovlivnit i koncentraci Ca v krevním séru.58
Z výše zmíněných faktů vyplývá, že mnohdy opomíjený Mg je naprosto nezbytný pro samotné vstřebávání Ca, dále pro regulaci procesů zodpovědných za tvorbu kostní tkáně a především je důležitý i v rámci udržování rovnováhy u Ca-indukovaných buněčných dějů. Dysregulace těchto dějů vyvolaná vyšším poměrem Ca:Mg může mít i svá rizika, proto byla kapitola 2.3.2 „Poměr Ca:Mg“ poměrně detailně diskutuována. V této části jsme se dozvědeli, že vyšší příjmy Ca (1400 mg) společně s nízkým příjmem Mg (250 mg) mohou vést k negativní rovnováze Mg, čili k jeho zhoršené absorpci a zvýšenému vylučování. Naproti tomu při zvýšení příjmu Mg na 500mg byla, i přes relativně vysoký příjem Ca, zaznamenána pozitivní rovnováha Mg.60, 61 V rámci této studie se jednalo o poměr Ca:Mg roven 1,7:1. Další studie sledující vstřebatelnost Mg v tenkém střevě zaznamenala určitou korelaci mezi vysokým poměrem a nižší vstřebatelností Mg.63
Jak již bylo zmíněno, Ca a Mg plní nejen svou strukturní roli v kostní tkáni, ale i jejich poměr reguluje buněčnou signalizaci, která ovlivňuje naše zdraví. V kapitole „Poměr Ca:Mg“ je zmiňován trend neustále se zvyšujícího se poměru Ca:Mg (2,3 – 3,53) v USA od roku 1977 až do roku 2008. Dále pak byla nalezena spojitost poměru Ca:Mg vyšším než 2,78 se zvyšujícím se rizikem rakoviny tlustého střeva.65 Na dané téma navázaly i další studie, kde byl pozorován zvyšující se výskyt koronárního onemocnění srdce společně se vzrůstajícím poměrem Ca:Mg.66, 67 Nejvyšší poměr Ca:Mg společně s nejčastějším výskytem CHD byl nalezen ve Finsku, kde je majoritním zdrojem Ca mléko a mléčné výrobky.66
Na závěr byly zmíněny práce zabývající se dynamickými změnami v koncentracích Ca a Mg uvnitř krevních buněk u pacientů pouze s hypertenzí, či v kombinaci s diabetem. V rámci této studie bylo prokázáno, že všechny formy hypertenze jsou charakteristické přebytkem volného Cai a nízkou koncentrací Mgi.69, 70 Ke stejným závěrům došel i Erne a kol. při studiu volného Cai v krevních destičkách od pacientů s hypertenzí.71 Jak se dále můžeme dočíst, tyto souvislosti platí i pro pacienty s inzulínovou rezistencí, obezitou a NIDDM. V této oblasti byl nalezen inverzní vztah mezi Mgi a hyperinsulemickou odpovědí na orální glukózový toleranční test (oGTT). Naopak tomu je to v případě Cai, kde byla pozorována přímá souvislost mezi zvyšujícím se Cai a zvýšenou hyperinsulemickou odpovědí. 72
Závěrem byla věnována pozornost regulační a protektivní roli Mg skrze TRPM7 kanály, které jsou společné pro Ca i Mg, v procesu vaskulární kalcifikace, ke které dochází v rámci aterosklerózy.76 Jak je patrné na buněčné úrovni, dysbalance Ca:Mg hraje svou roli, a proto bychom měli brát v potaz patrná rizika vztahující se k neustálému zvyšování poměru Ca:Mg ve stravě pro všechny skupiny lidí (konvenčně se stravující, vegetariány, či vegany).
2.4 Železo a ostatní nutrienty
1) paní Dostálová: Zmiňuje maso jako zdroj železa a zinku z hlediska lepší využitelnosti, než u rostlinných zdrojů.
pan Jaroslav Škvařila:železo a zinek jsou v rostlinách v nadbytku...
paní Dostálová: železo a zinek jsou v rostlinách ve formě, které náš organismus nevyužije…
pan Jaroslav Škvařil: …záleží jakým způsobem… (přerušen)
paní Dostálová: ,, Železo a zinek jsou z masa. ”
pan Jaroslav Škvařil: zmínka o nebezpečnosti nadbytku železa (především hemového) .
V souvislosti s příjmem a vstřebatelností železa a zinku bych chtěl sdělit několik zajímavých a často mýty-vyvracejících argumentů, opírajících se o podložená fakta. Především bylo zjištěno, že v západní civilizaci není nutné řešit otázku nedostatku zinku a to z důvodu prakticky neexistující deficience zinku v této populaci.78
V otázce železa, konkrétně tedy ne-hemového, které je převážně zastoupené v rostlinných zdrojích, můžeme najít určitá omezení. Mnoho potravin obsahuje železo v poměrně velkém množství, nicméně jeho vstřebatelnost je limitována přítomností skupiny látek zvaných antinutrienty např. fytáty, oxaláty, polyfenoly a v menší míře i vlákninou. 79
Na druhou stranu je velice důležité zdůraznit, že tento ,,handicap“ lze vyřešit jednoduchými technikami úpravy potravin jako je namáčení, klíčení nebo kynutí chleba tradičním kváskem, čímž docílíme výrazného snížení množství fytátů, a následně zaručíme zvýšení biodostupnosti ne-hemové železa z potravy.80-82
Velice významnou roli v příjímání ne-hemového železa hrají tzv. enhancery příjmu železa, tedy látky schopné zvyšovat schopnost příjmat železo. Zástupci této skupiny jsou např. organické kyseliny vyskytující se často v ovoci (např.: kyselina askorbová – vit. C, citronová, jablečná, mléčná, vinná apod.).83, 84 Dalším významným faktem je i výskyt určité adaptace u jedinců stravujících se vegetariánskou či veganskou stravou, u kterých dochází ke zvýšení schopnosti příjímat ne-hemové železo z potravy a naopak snížení jeho exkrece.85, 86
Zmínka o nebezpečnosti nadbytku železa byla studována v celé řadě prací. Pro příklad uvádím studie, kde byla pozorována závislost vysokého příjmu hemového železa na vzniku rizika87 popř. mortalitě88 koronárního onemocnění srdce a kardiovaskulárních onemocnění.87
Naproti tomu s velice zajímavým výsledkem přišla meta-analýza kohortových studií, která neprokázala žádnou souvislost mezi příjmem ne-hemového železa a incidencí koronárního onemocnění srdce.88
K vysokému příjmu hemového železa dochází především díky faktu, že tento druh železa obchází regulační mechanismy, kterými se řídí příjem ne-hemové železa a tím pádem dojde lehce k výskytu jeho vyšších hodnot v krvi.89, 90
2.) paní Dostálová: ,,Ovoce a zelenina až na některé výjimky neobsahují tuky. Běžné druhy ovoce a zeleniny tuky neobsahují, takže máte deficit řady živin…”
Jak jsem již předeslal v sekci 2.1 „Nepochopení výživových směrů“, žádný ze základních a nejpočetnějších vegetariánských směrů stravování se neomezuje pouze na konzumaci zeleniny a ovoce, nýbrž zahrnuje mimo luštěniny a obiloviny poměrně rozsáhlou a nutričně bohatou skupinu potravin – oříšky a semínka. Zde je nutné si hlídat poměr mezi omega-3 a omega-6 mastnými kyselinami. Dle současných poznatků by se měl pohybovat ku prospěchu omega-3 mastných kyselin.
Významnými zdroji těchto esenciálních mastných kyselin, především však kyseliny ALFA (α-Linolenová kyselina) jsou chia, lněná semínka popř. za studena lisovaný lněný olej či řepkový olej.91 Proto není nutné se obávat deficitu těchto esenciálních mastných kyselin.
Další informace:
Mgr. Gabriel Gonzalez Email: Tato e-mailová adresa je chráněna před spamboty. Pro její zobrazení musíte mít povolen Javascript.
Reference
1. Young VR, Fajardo L, Murray E, Rand WM, Scrimshaw NS. Protein requirements of man: comparative nitrogen balance response within the submaintenance-to-maintenance range of intakes of wheat
and beef proteins. J Nutr. 1975;105(5):534-542.
2. Kate A Marsh EAM, Surinder K Baines. Protein and vegetarian diets. MJA Open. 2012;1(2):7-10.
3. Craig WJ, Mangels AR. Position of the American Dietetic Association: vegetarian diets. J Am Diet Assoc. 2009;109(7):1266-1282.
4. Fuller MF, Reeds PJ. Nitrogen cycling in the gut. Annu Rev Nutr. 1998;18:385-411.
5. Millward DJ, Forrester T, Ah-Sing E, et al. The transfer of 15N from urea to lysine in the human infant. Br J Nutr. 2000;83(5):505-512.
6. Joint FAO/WHO/UNU, Protein and amino acid requirements in human nutrition: report of a joint FAO/WHO/UNU expert consultation. Geneva: World Health Organization: 2007:265.
7. Mangels R, Messina V, Messina M. The Dietitian's Guide to Vegetarian Diets: Issues and Applications. Jones and Bartlett; 2004.
8. Medicine Io. Dietary Reference Intakes for Energy, Carbohydrate, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids (Macronutrients). Washington, DC: The National Academies Press; 2005.
9. Katan MB, Grundy SM, Jones P, Law M, Miettinen T, Paoletti R. Efficacy and safety of plant stanols and sterols in the management of blood cholesterol levels. Mayo Clin Proc. 2003;78(8):965-978.
10. Rimbach G, Boesch-Saadatmandi C, Frank J, et al. Dietary isoflavones in the prevention of cardiovascular disease--a molecular perspective. Food Chem Toxicol. Apr 2008;46(4):1308-1319.
11. Ma DF, Qin LQ, Wang PY, Katoh R. Soy isoflavone intake increases bone mineral density in the spine of menopausal women: meta-analysis of randomized controlled trials. Clin Nutr. 2008;27(1):57-64.
12. Liu RH. Health benefits of fruit and vegetables are from additive and synergistic combinations of phytochemicals. Am. J. Clin. Nutr. 2003;78(3 Suppl):517S-520S.
13. Perez-Vizcaino F, Duarte J, Andriantsitohaina R. Endothelial function and cardiovascular disease: effects of quercetin and wine polyphenols. Free Radic Res. 2006;40(10):1054-1065.
14. Lin CL, Fang TC, Gueng MK. Vascular dilatory functions of ovo-lactovegetarians compared with omnivores. Atherosclerosis 2001;158(1):247-251.
15. Charles P, Jensen FT, Mosekilde L, Hansen HH. Calcium metabolism evaluated by 47Ca kinetics: estimation of dermal calcium loss. Clin Sci (Lond). 1983;65(4):415-422.
16. Hasling C, Charles P, Jensen FT, Mosekilde L. Calcium metabolism in postmenopausal osteoporosis: the influence of dietary calcium and net absorbed calcium. J. Bone Miner. Res. 1990;5(9):939-946.
17. FAO, WHO. Human vitamin and Mineral Requirements: Report of a Joint FAO/WHO Expert Consultation, Bangkok, Thailand: World Health Organization; 2001, 281.
18. FAO, WHO. Human vitamin and mineral requirements in human nutrition. Geneva: World Health Organization; 2003, 148.
19. Clarys P, Deliens T, Huybrechts I, et al. Comparison of Nutritional Quality of the Vegan, Vegetarian, Semi-Vegetarian, Pesco-Vegetarian and Omnivorous. Diet. Nutrients. 2014;6(3):1318-1332.
20. Walser M. Calcium clearance as a function of sodium clearance in the dog. Am. J. Physiol. 1961;200:1099-1104.
21. Nordin BE, Polley KJ. Metabolic consequences of the menopause. A cross-sectional, longitudinal, and intervention study on 557 normal postmenopausal women. Calcif. Tissue Int. 1987;41 Supp1:S1-59.
22. Sabto J, Powell MJ, Breidahl MJ, Gurr FW. Influence of urinary sodium on calcium excretion in normal individuals. A redefinition of hypercalciuria. Med. J. Aust. 17 1984;140(6):354-356.
23. Heaney RP. Protein intake and the calcium economy. J. Am. Diet Assoc. 1993;93(11):1259-1260.
24. Kerstetter JE, Allen LH. Dietary Protein Increases Urinary Calcium. J. Nutr. 1990;120(1):134-136.
25. Nordin BEC. Calcium and osteoporosis. Nutrition. 13(7):664-686.
26. Weaver CM, Proulx WR, Heaney R. Choices for achieving adequate dietary calcium with a vegetarian diet. Am. J. Clin. Nutr. 1999;70(3 Suppl):543S-548S.
27. Zhao Y, Martin BR, Weaver CM. Calcium bioavailability of calcium carbonate fortified soymilk is equivalent to cow's milk in young women. J. Nutr. 2005;135(10):2379-2382.
28. Diet, nutrition and the prevention of chronic diseases. World Health Organ Tech Rep Ser. 2003;916:I-VIII, 1-149.
29. Chai W, Liebman M. Effect of different cooking methods on vegetable oxalate content. J. Agric. Food Chem. 20 2005;53(8):3027-3030.
30. Hegsted DM. Calcium and osteoporosis. J. Nutr. Nov. 1986;116(11):2316-2319.
31. Abelow BJ, Holford TR, Insogna KL. Cross-cultural association between dietary animal protein and hip fracture: a hypothesis. Calcif. Tissue Int. 1992;50(1):14-18.
32. Feskanich D, Willett WC, Stampfer MJ, Colditz GA. Protein consumption and bone fractures in women. Am. J. Epidemiol. 1996;143(5):472-479.
33. Peacock M. Calcium metabolism in health and disease. Clin. J. Am. Soc. Nephrol. 2010;5 Suppl 1:S23-30.
34. Aaron JE, Gallagher JC, Anderson J, et al. Frequency of osteomalacia and osteoporosis in fractures of the proximal femur. Lancet 1974;1(7851):229-233.
35. Aaron JE, Gallagher JC, Nordin BE. Seasonal variation of histological osteomalacia in femoral-neck fractures. Lancet 1974;2(7872):84-85.
36. Baker MR, McDonnell H, Peacock M, Nordin BE. Plasma 25-hydroxy vitamin D concentrations in patients with fractures of the femoral neck. Br. Med. J. 1979;1(6163):589.
37. Morris HA, Morrison GW, Burr M, Thomas DW, Nordin BE. Vitamin D and femoral neck fractures in elderly South Australian women. Med. J. Aust. 1984;140(9):519-521.
38. von Knorring J, Slatis P, Weber TH, Helenius T. Serum levels of 25-hydroxyvitamin D, 24,25-dihydroxyvitamin D and parathyroid hormone in patients with femoral neck fracture in southern Finland. Clin Endocrinol (Oxf). 1982;17(2):189-194.
39. Pun KK, Wong FH, Wang C, et al. Vitamin D status among patients with fractured neck of femur in Hong Kong. Bone, 1990;11(5):365-368.
40. Lund B, Sorensen OH, Christensen AB. 25-Hydroxycholecaliferol and fractures of the proximal. Lancet, 1975;2(7929):300-302.
41. Feskanich D, Willett WC, Stampfer MJ, Colditz GA. Milk, dietary calcium, and bone fractures in women: a 12-year prospective study. Am. J. Public Health, 1997;87(6):992-997.
42. Schuette SA, Zemel MB, Linkswiler HM. Studies on the mechanism of protein-induced hypercalciuria in older men and women. J. Nutr., 1980;110(2):305-315.
43. Hegsted M, Linkswiler HM. Long-term effects of level of protein intake on calcium metabolism in young adult women. J. Nutr., 1981;111(2):244-251.
44. Lutz J. Calcium balance and acid-base status of women as affected by increased protein intake and by sodium bicarbonate ingestion. Am. J. Clin. Nutr.,1984;39(2):281-288.
45. Breslau NA, Brinkley L, Hill KD, Pak CY. Relationship of animal protein-rich diet to kidney stone formation and calcium metabolism. J. Clin. Endocrinol. Metab.,1988;66(1):140-146.
46. Margen S, Chu J-Y, Kaufmann NA, Calloway DH. Studies in calcium metabolism. I. The calciuretic effect of dietary protein. Am. J. Clin. Nutr., 1974 1974;27(6):584-589.
47. Robertson WG, Peacock M, Heyburn PJ, et al. Should recurrent calcium oxalate stone formers become vegetarians? Br. J. Urol. 1979;51(6):427-431.
48. Alfrey AC, Miller NL. Bone Magnesium Pools in Uremia. J. Clin. Invest. 1973;52(12):3019-3027.
49. Creedon A, Flynn A, Cashman K. The effect of moderately and severely restricted dietary magnesium intakes on bone composition and bone metabolism in the rat. Br. J. Nutr., 1999;82(1):63-71.
50. Boskey AL, Rimnac CM, Bansal M, Federman M, Lian J, Boyan BD. Effect of short-term hypomagnesemia on the chemical and mechanical properties of rat bone. J. Orthop Res.1992;10(6):774-783.
51. Schwartz R, Reddi AH. Influence of magnesium depletion on matrix-induced endochondral bone formation. Calcif. Tissue Int., 1979;29(1):15-20.
52. Rude RK, Kirchen ME, Gruber HE, Meyer MH, Luck JS, Crawford DL. Magnesium deficiency-induced osteoporosis in the rat: uncoupling of bone formation and bone resorption. Magnes. Res. 1999;12(4):257-267.
53. Rude RK, Gruber HE, Wei LY, Frausto A, Mills BG. Magnesium deficiency: effect on bone and mineral metabolism in the mouse. Calcif. Tissue Int., 2003;72(1):32-41.
54. Rude RK, Singer FR, Gruber HE. Skeletal and hormonal effects of magnesium deficiency. J. Am. Coll. Nutr., 2009;28(2):131-141.
55. Steven A. Abrams ZC, Keli M. Hawthorne. Magnesium, but not calcium intake is significantly association with bone mineral status in 4 to 8 year old children. Pediatric Nutrition. Washington
Convetion Center; 2013.
56. Carpenter TO, DeLucia MC, Zhang JH, et al. A randomized controlled study of effects of dietary magnesium oxide supplementation on bone mineral content in healthy girls. J. Clin. Endocrinol. Metab. 2006;91(12):4866-4872.
57. Ryder KM, Shorr RI, Bush AJ, et al. Magnesium intake from food and supplements is associated with bone mineral density in healthy older white subjects. J. Am. Geriatr. Soc. 2005;53(11):1875-1880.
58. Pironi L, Malucelli E, Guidetti M, et al. The complex relationship between magnesium and serum parathyroid hormone: a study in patients with chronic intestinal failure. Magnes Res. 2009;22(1):37-43.
59. Portelli C. The synergism and antagonism of cations. Physiologie, 1982;19(4):229-231.
60. Spencer H. Magnesium in Health and Disease. Jamaica, NY, 1980.
61. Seelig M.S. Magnesium Deficiency in the Pathogenesis of Disease. .New York, NY. : Plenum Books Company. 1980, 488.
62. Irwin MI, Feeley RM. Frequency and size of meals and serum lipids, nitrogen and mineral retention, fat digestibility, and urinary thiamine and rib.oflavin in young women. Am. J. Clin. Nutr. 1967;20(8):816-824.
63. Norman DA, Fordtran JS, Brinkley LJ, et al. Jejunal and ileal adaptation to alterations in dietary calcium: changes in calcium and magnesium absorption and pathogenetic role of parathyroid hormone
and 1,25-dihydroxyvitamin D. J. Clin. Invest. 1981;67(6):1599-1603.
64. Rosanoff A. Rising Ca:Mg intake ratio from food in USA Adults: a concern? Magnes. Res. 2010;23(4):S181-193.
65. Dai Q, Shrubsole MJ, Ness RM, et al. The relation of magnesium and calcium intakes and a genetic polymorphism in the magnesium transporter to colorectal neoplasia risk. Am. J. Clin. Nutr.
2007;86(3):743-751.
66. Varo P. Mineral element balance and coronary heart disease. Int. J. Vitam. Nutr. Res., 1974;44(2):267-273.
67. Keys A. Coronary heart disease in seven countries. Nutrition., 1997;13(3):250-252; discussion 249, 253.
68. Seelig MS. Human requirements of magnesium: factors that increase needs. In: Durlach J, ed. First International Symposium on Magnesium Deficiency in Human Pathology,Vittel: SGEMV; French;
1971:11–38.
69. Resnick LM. Ionic Basis of Hypertension, Insulin Resistance, Vascular Disease, and Related Disorders The Mechanism of “Syndrome X”. Am. J. Hypertens. 1993;6(4S):123S-134S.
70. Resnick LM, Gupta RK, Bhargava KK, Gruenspan H, Alderman MH, Laragh JH. Cellular ions in hypertension, diabetes, and obesity. A nuclear magnetic resonance spectroscopic study. Hypertension.
1991;17(6 Pt 2):951-957.
71. Erne P, Bolli P, Burgisser E, Buhler FR. Correlation of platelet calcium with blood pressure. Effect of antihypertensive therapy. N. Engl. J. Med. 1984;310(17):1084-1088.
72. Resnick LM, Gupta RK, Gruenspan H, Alderman MH, Laragh JH. Hypertension and peripheral insulin resistance. Possible mediating role of intracellular free magnesium. Am. J. Hypertens.
1990;3(5 Pt 1):373-379.
73. Resnick L GR, Laragh J: RBC cytosolic free calcium levels in hypertension: Relation to blood pressure and other cations (abst). Am J Hypertens., 1990;3:59A.
74. Rayssiguier Y, Libako P, Nowacki W, Rock E. Magnesium deficiency and metabolic syndrome: stress and inflammation may reflect calcium activation. Magnes. Res., 2010;23(2):73-80.
75. Yogi A, Callera GE, Antunes TT, Tostes RC, Touyz RM. Vascular biology of magnesium and its transporters in hypertension. Magnes Res., 2010;23(4):S207-215.
76. Montezano AC, Zimmerman D, Yusuf H, et al. Vascular smooth muscle cell differentiation to an osteogenic phenotype involves TRPM7 modulation by magnesium. Hypertension. 2010;56(3):453-462.
77. Appleby P, Roddam A, Allen N, Key T. Comparative fracture risk in vegetarians and nonvegetarians in EPIC-Oxford. Eur. J. Clin. Nutr., 2007;61(12):1400-1406.
78. Davey GK, Spencer EA, Appleby PN, Allen NE, Knox KH, Key TJ. EPIC-Oxford: lifestyle characteristics and nutrient intakes in a cohort of 33 883 meat-eaters and 31 546 non meat-eaters in the UK.
Public Health Nutr. 2003;6(3):259-269.
79. Coudray C, Bellanger J, Castiglia-Delavaud C, Remesy C, Vermorel M, Rayssignuier Y. Effect of soluble or partly soluble dietary fibres supplementation on absorption and balance of calcium, magnesium, iron and zinc in healthy young men. Eur. J. Clin. Nutr.,1997;51(6):375-380.
80. Harland BF, Morris ER. Phytate: A good or a bad food component? Nutrition Research., 1995;15(5):733-754.
81. Sandberg AS, Brune M, Carlsson NG, Hallberg L, Skoglund E, Rossander-Hulthen L. Inositol phosphates with different numbers of phosphate groups influence iron absorption in humans.
Am. J. Clin. Nutr., 1999;70(2):240-246.
82. Manary MJ, Krebs NF, Gibson RS, Broadhead RL, Hambidge KM. Community-based dietary phytate reduction and its effect on iron status in Malawian children.
Ann. Trop. Paediatr., 2002;22(2):133-136.
83. Hallberg L, Hulthen L. Prediction of dietary iron absorption: an algorithm for calculating absorption and bioavailability of dietary iron. Am. J. Clin. Nutr., 2000;71(5):1147-1160.
84. Fleming DJ, Jacques PF, Dallal GE, Tucker KL, Wilson PW, Wood RJ. Dietary determinants of iron stores in a free-living elderly population: The Framingham Heart Study. Am. J. Clin. Nutr.,
1998;67(4):722-733.
85. Hunt JR, Roughead ZK. Nonheme-iron absorption, fecal ferritin excretion, and blood indexes of iron status in women consuming controlled lactoovovegetarian diets for 8 wk.
Am. J. Clin Nutr. May 1999;69(5):944-952.
86. Hunt JR, Roughead ZK. Adaptation of iron absorption in men consuming diets with high or low iron bioavailability. Am. J. Clin. Nutr., 2000;71(1):94-102.
87. Qi L, van Dam RM, Rexrode K, Hu FB. Heme iron from diet as a risk factor for coronary heart disease in women with type 2 diabetes. Diabetes Care, 2007;30(1):101-106.
88. Hunnicutt J, He K, Xun P. Dietary Iron Intake and Body Iron Stores Are Associated with Risk of Coronary Heart Disease in a Meta-Analysis of Prospective Cohort Studies. J. Nutr., 2013.
89. Cook JD. Adaptation in iron metabolism. Am. J. Clin. Nutr., 1990;51(2):301-308.
90. Bothwell THC, R. W.; Cook, J. D.; Finch, C. A. Iron metabolism in man. Oxford 1979.
91. Geppert J, Kraft V, Demmelmair H, Koletzko B. Docosahexaenoic acid supplementation in vegetarians effectively increases omega-3 index: a randomized trial. Lipids. 2005;40(8):807-814.












